引言:冠心病是导致人类疾病死亡的首位原因,血管支架介入治疗广泛应用于对危重冠心病患者的救治。但至今为止,临床应用的支架依然面临着再狭窄和晚期血栓等并发症,制约着血管支架临床治疗效果的提升。而导致临床并发症的根本原因在于,这些支架在功能设计理念上存在误区。纵观血管支架表面功能设计研究的发展进程,截至目前,只有少数学者意识到“病变血管修复和具有正常生理功能的内皮组织再生”这一生理过程的发展对血管支架有着特定的“时序功能”需求。早在2012年于成都召开的“第九届世界生物材料大会”上,黄楠教授率先正式提出“时序功能”血管支架设计的理论。而该理论的诞生源于对支架植入后相继引起的“血栓、炎症、内膜增生、基质沉积和血管重塑,从而导致架再狭窄”等一系列病理响应的发生具有“时间先后顺序”的充分认识。基于该理论,近10年来,黄楠和杨志禄教授原创发展的以“内皮功能仿生”设计理念为指导的系统性表面功能改性技术应用于血管支架取得了突破性进展,在著名国际期刊Chemistry of Materials, Biomaterials, NPG Asia Materials上发表高水平科研论文20余篇(其中IF>10的论文10篇),获得发明专利6项(其中包括美国发明专利1项),其中发展的完全自主知识产权的“具有病灶治愈和血管组织修复功能的可降解支架涂层技术”已成功实现转让(转让费:1500万)。
近几年,为了研发具有病灶治愈和血管组织修复功能的新一代血管支架,黄楠和杨志禄教授在此前的研究工作基础之上,进一步发展出包括贻贝灵感“组合表面化学”及“金属-酚(胺)”表面化学等原创性的新型支架表面改性技术。研究结果证实,该技术的应用,不仅能赋予血管支架表面仿生天然血管内皮长期、持续、稳定、可控释放理疗气体一氧化氮(NO),而且在支架表面引入了丰富的反应性官能团用于与NO具有功能协同和互补作用的生物活性分子接枝,显著地提高了血管支架在动物体内的治疗效果。最近,黄楠和杨志禄教授就该系列研究在国际著名期刊Research和Biomaterials上连发三篇高质量论文。
(一)Biomaterials: 贻贝灵感“组合表面化学”构建快速内皮再生修复心血管支架
针对高发的动脉粥样硬化,临床上的主要治疗手段血管支架植入能够迅速有效地恢复血运重建,挽救患者生命。目前最广泛应用的药物洗脱支架(DES)虽然能够有效地降低支架的再狭窄,但药物毒性造成的内皮化延迟和再生内皮“功能不完全”无法长期有效抑制平滑肌细胞增殖和迁移,最终导致再狭窄(ISR)和晚期血栓的高发。由此可见支架内皮早期修复和再内皮化是预防再狭窄,降低晚期血栓发生率的关键。
基于此,在黄楠和杨志禄教授的指导下,课题组博士研究生李向阳(于2019年6月毕业,引进到安徽医科大学工作)通过顺序堆叠“铜-多巴胺”(CuII-DA)和聚多巴胺(pDA)涂层,形成有效的二次反应界面(图1)。协同利用复合涂层中的CuII-DA网络结构中的铜离子和酚羟基,在赋予血管支架类谷胱甘肽过氧化物酶(GPx)活性催化分解内源性S-亚硝基硫醇(RSNO)生成NO的同时,实现巯基化的内皮选择性多肽HS-Arg-Glu-Asp-Val(HS-REDV)共价接枝的协同修饰。
该研究引入功能分子协同修饰的设计理念,成功构建了一种既具有NO催化能力又能够有效促进内皮细胞粘附和生长的支架涂层。其体外细胞培养,半体内循环以及体内动物实验结果均表明该涂层具有选择性促进内皮细胞粘附和生长功能的同时,又可以实现抗凝和持续抑制平滑肌细胞的功能,有望降低临床支架应用面临的支架再狭窄和晚期血栓发生风险。此外,该心血管支架表面改性策略,对后续多功能化心血管支架表面功能设计奠定力量基础和提供指导。相关研究发表在生物材料领域旗舰期刊Biomaterials(2020;241:119904, IF: 10.273)。
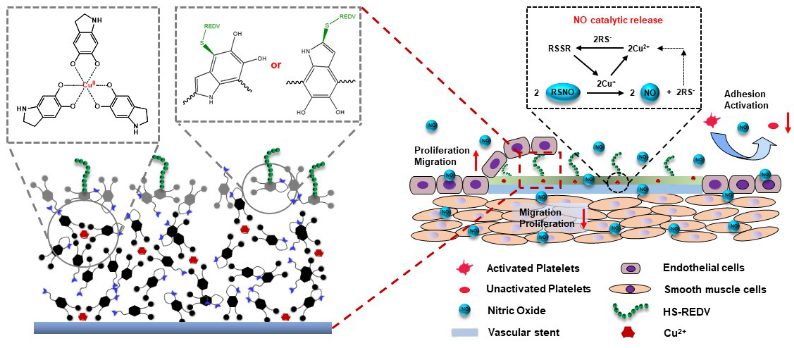
图1. 贻贝灵感“组合表面化学”构建快速内皮再生修复心血管支架示意图。
原文链接:https://www.sciencedirect.com/science/article/pii/S0142961220301502
(二)Biomaterials:“金属-酚(胺)”表面化学用于理疗气体催化及生物分子协同修饰
冠脉支架作为一类侵入式的永久性植入器械,用于心血管疾病重症患者的救治,其应用的血管病理环境对其功能有着严苛的多重需求。作为一种理想的血管支架,在生物学功能上不仅要求其满足抗凝血、调控炎症、抑制支架植入后引发的内膜增生,还需要其对病变血管组织具有再生修复功能。目前,实现血管支架表面多功能修饰的方法主要是基于物理装载、静电自组装或“一锅法”分子共固定等技术在其表面引入在功能上具有互补或协同作用的两种或多种生物活性分子。然而,这些方法通常会涉及到复杂多步骤的工艺(如静电自组装)、需对血管支架表面进行复杂的预处理(如静电自组装)、修饰的分子之间容易发生化学交联导致其严重的失活(如“一锅法”分子共固定)、修饰分子容易从支架表面流失使其功能得不到保障(如物理装载)等缺陷,限制其临床转化、应用或治疗效果。
针对于这一类具有多功能需求的生物医用器械,在黄楠/杨志禄教授指导下,课题组博士研究生高鹏发展出一种新颖的“金属-酚-(胺)”表面化学改性策略,用于以冠脉支架为例的永久性植入器械的表面多功能化设计研究。研究选用Cu2+、多巴胺(DA)及己二胺(HD)分子为表面改性原料,在弱碱性水相条件下,基于“分子/离子共组装”原理,通过“一步法”在血管支架表面构建“金属-酚-胺”即CuII-DA/HD网络结构的纳米涂层(图2)。金属铜离子的引入赋予了血管支架原位催化血液中内源性一氧化氮(NO)供体持续、稳定释放理疗气体NO,而涂层表面引入的丰富的反应性官能团伯氨基(-NH2)为表面二次功能分子接枝提供了平台。尤为值得一提的是,通过调整Cu2+、DA与HD的投料化学计量比,能够轻易实现涂层表面Cu2+与-NH2含量的调控,从而实现NO 催化释放速率和二次功能分子接枝量的调控,且二次功能分子接枝对涂层NO 催化活性影响极小。该方法不仅具有成本低、工艺简单易操作、不涉及到有毒试剂或有机溶剂,而且适用于广谱材料表面改性。此外,该“金属-酚-(胺)”表面化学不局限于Cu2+的使用,适用于广谱的过渡金属离子,根据实际应用需求可对材料/器械表面进行个性化功能设计,是一种简单、行之有效的表面改性新策略。相关研究发表在生物材料领域旗舰期刊Biomaterials(2020;248:119981, IF: 10.273)。
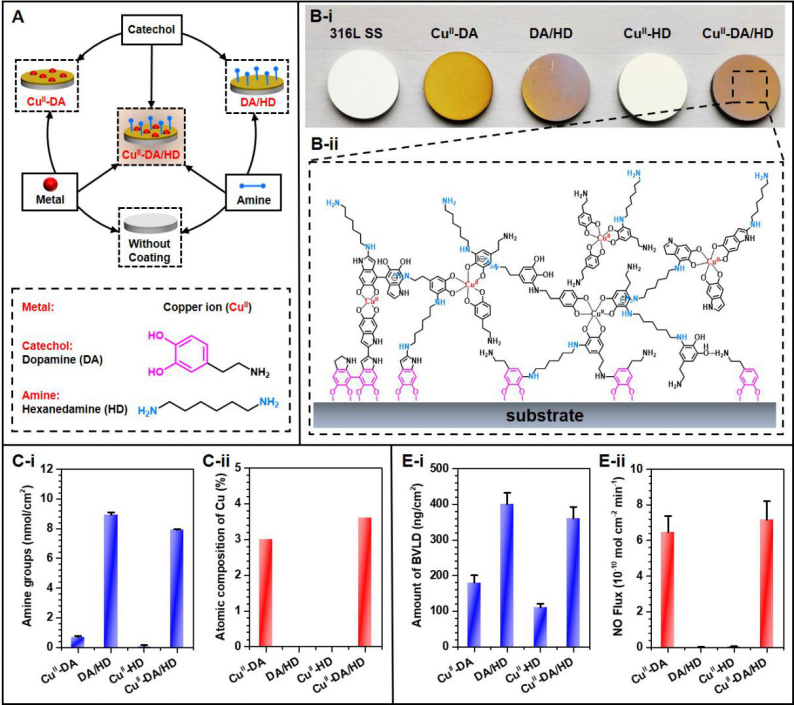
图2.“金属-酚(胺)”表面化学构建具有NO催化活性及丰富氨基官能团粘附涂层。
原文链接:https://doi.org/10.1016/j.biomaterials.2020.119981
(三)Research:“金属-酚(胺)”表面化学用于构建具有高度内皮功能仿生冠脉支架研究
分布在血管内壁的内皮细胞层是血液与血管组织的物理屏障,它不仅能完成血液和组织液的物质交换,并且能通过合成或分泌多种生物活性物质以确保血管正常的收缩和舒张,发挥维持血管张力,抑制平滑肌增生,调节炎症反应、血压以及凝血与抗凝平衡等多种功能,进而保持血液的正常流动和血管的长期通畅。此外,健康完整的内皮细胞层也是阻止动脉粥样硬化斑块形成的天然屏障。内皮细胞功能的发挥主要是依赖其分泌的活性因子(如前列环素(PGI2)和NO等)和细胞膜表面分布的生物活性分子如蛋白和粘多糖(如乙酰肝素)通过功能协同和互补作用实现。而内皮细胞功能的发挥很大程度上依赖于NO和乙酰肝素,这是由于这两类功能分子不仅拥有内皮细胞所具有的多重生物学功能,此外,二者在功能发挥上还存在着协同和互补作用。通过表面工程技术,在血液接触类材料/器械(包括血管支架)表面引入NO和肝素(乙酰肝素的衍生物,二者具有非常类似的生理功能)模仿天然血管内皮细胞功能引起了科研工作者的极大兴趣。而在血管支架表面同时引入NO和肝素被证实能够有效降低血管支架临床并发症(如支架内再狭窄和晚期血栓等)的发生率。相关研究发表在国际知名期刊Research(2020; doi.org/10.34133/2020/9203906, 《Science》自1880年创建以来第一本合作期刊)。
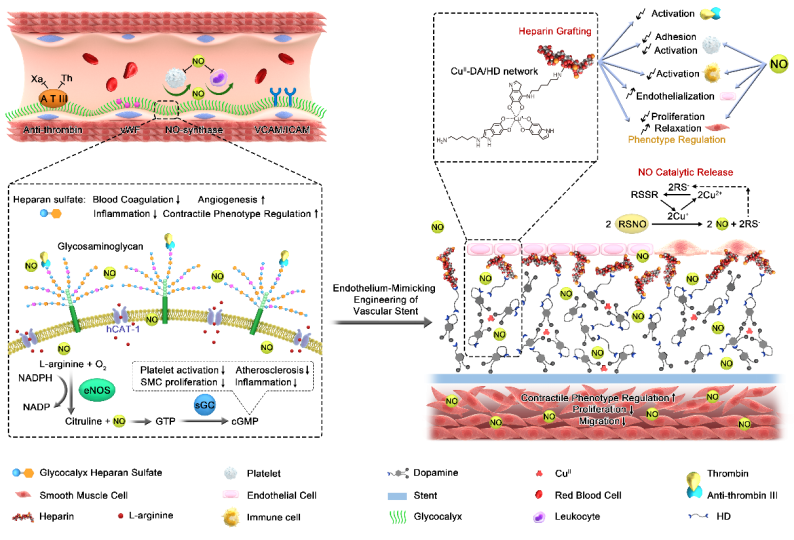
图3.“金属-酚(胺)”表面化学构建具有高度内皮功能仿生心血管支架示意图。
然而,由于血管支架表面缺乏固定NO和肝素的反应性基团,而现有的技术也存在难以实现支架表面NO和肝素引入量和生物活性保持力的统一,限制其在模仿内皮功能上的发挥。为了打破技术瓶颈上的壁垒,黄楠/杨志禄教授采用自主开发的“金属-酚-(胺)”表面涂层技术,通过逐步修饰策略,实现了血管支架表面基于NO和肝素协同修饰的内皮功能仿生设计。基于“金属-酚-(胺)”表面涂层改性技术在血管支架表面构建的CuII-DA/HD纳米涂层,不仅赋予了血管支架长期、持续、稳定及可控NO催化释放能力,且表面引入的丰富反应性基团氨基实现了高密度的肝素共价固定,固定的肝素保持了高度的生物活性(图3)。通过优化NO和肝素的修饰计量,实现了血管支架内皮功能仿生的最优化设计。该技术构建的内皮功能仿生涂层应用于支架表面改性,赋予了支架优异的抗血栓、调控炎症、促进内皮再生和抑制支架再狭窄的能力(图4),为发展具有病灶治愈和血管组织修复功能的新一代血管支架提供了极其宝贵的思路、指导及奠定了坚实的基础。

图4. 基于“金属-酚(胺)”表面化学构建的具有高度内皮功能仿生涂层改性心血管支架植入新西兰大白兔髂动脉2周,1个月及3个月的结果。
原文链接:https://spj.sciencemag.org/research/aip/9203906/
黄楠教授简介:
教授,博士生导师,国家百千万人才,国务院政府特殊津贴获得者。中国最早开展心血管生物材料研究的学者之一,我国心血管生物材料领域战略发展计划的规划者之一。国际生物材料科学与工程联合会Fellow,生物材料表面与界面国际会议国际委员会主席。先后主持承担“973”、“863”项目、国家自然科学基金重点项目及面上项目等3000余万元,发展出具有自主知识产权的系列心血管材料表面改性的先进技术和心血管植入介入器械的关键技术,所研究的具有我国自有知识产权的血管支架临床应用被证实优于国内外现有产品(目前临床应用已超过20万例)。申请及获得专利80余项。获得省部级科技进步奖3项,发表SCI收录论文近300篇,被他人引用超1万余次。国际会议大会报告、邀请报告40余次。
黄楠教授主页:https://faculty.swjtu.edu.cn/huangnan/zh_CN/index.htm
杨志禄研究员简介:
研究员,博士生导师,四川省杰出青年基金获得者,四川省学术和技术带头人后备人选,皇冠“扬华学者”。目前,担任KeAi旗下国际期刊Smart Materials in Medicine主编、Engineered Regeneration编委、Bioactive Materials及Medical Gas Research客座主编。主要研究方向聚焦冠脉血管动脉粥样硬化斑块的病理发生机制、以及针对性用于冠脉/外周血管疾病治疗的纳米靶向药物、药物球囊及具有病灶治愈和血管组织修复功能的血管支架研究;以第一/通讯作者在Research,Chemistry of Materials,Biomaterials (9篇),NPG Asia Materials以及ACS Applied Materials and Interfaces等国际期刊上共发表三大检索收录论文40余篇(其中IF>10的论文10篇,IF=8-10的论文7篇)。国际/国内会议大会报告、邀请报告10余次。申请及获得发明专利20余项(包括美国发明专利1项),其中发展的具有自主知识产权的“具有病灶治愈和血管组织修复功能的可降解支架涂层”技术已成功实现转让(转让费:1500万)。
杨志禄研究员主页:https://faculty.swjtu.edu.cn/yangzhilu/zh_CN/index.htm